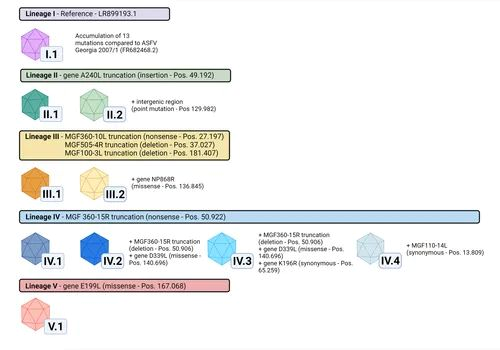
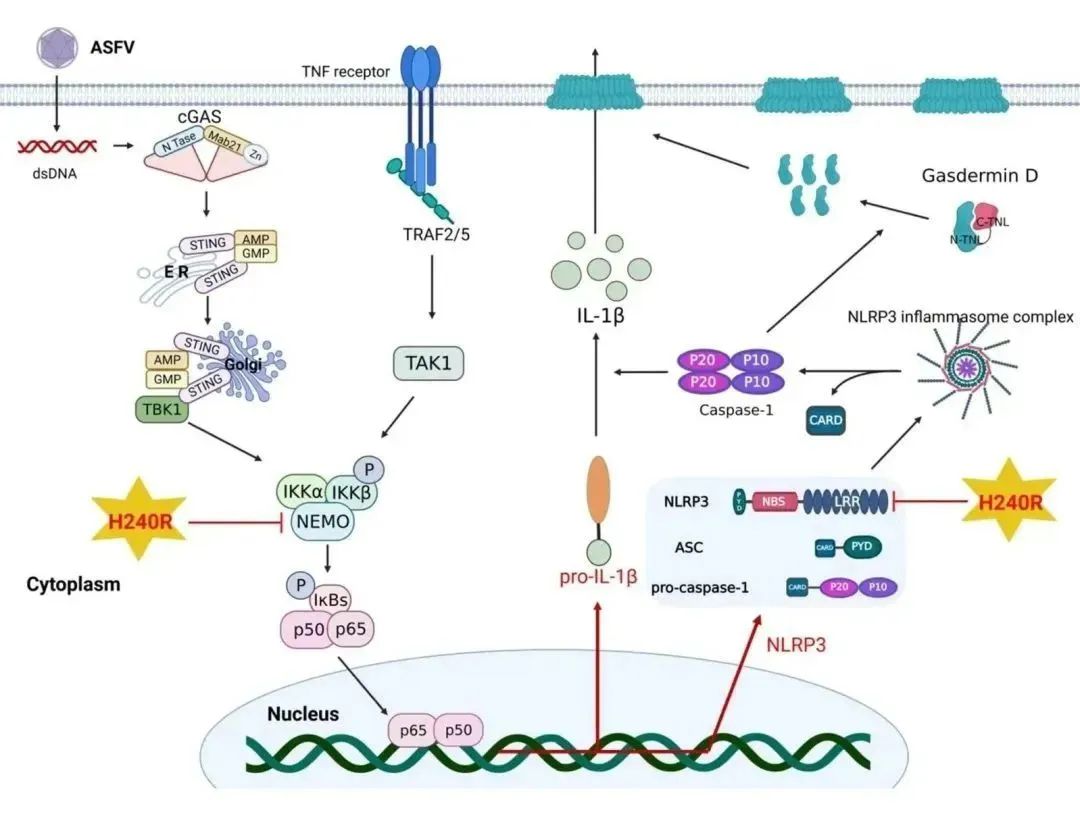
外网消息 最近由德国弗里德里希•洛夫勒研究所(FLI)开展的一项研究得出了出乎意料的结果。2020年,非洲猪瘟进入德国东部的野猪群。对最初发现的病毒的全基因组测序显示,该毒株与已知在波兰西部流行的毒株相似,这一发现并没有什么特别意义。但是令人惊讶的是,随后在德国发现了许多非洲猪瘟变体,这些新变体的突变特征是影响已知的非瘟病毒开放阅读框(ORF)的高影响突变,这些突变以前从未被描述过。虽然一些变化影响了病毒基因组中可能与潜在的免疫调节器或毒力因素有关的区域,但大多数突变的影响仍然是未知的。因此,他们对这些新的遗传变异进行了更详细的调查:仅在非洲猪瘟进入德国传播的一年之内,就已经形成了至少5个谱系10个变体,并且在德国形成了几个地理集群,这些集群可以被分配到遗传上不同的、迄今为止未被描述的病毒亚群。来自德国因塞尔里姆斯弗里德里希-洛弗勒研究所的一份针对猪ASFV(非洲猪瘟)带毒状态的研究报告,实验共用了36头猪,历时165天,得到了一个明确的结果:阴性哨兵猪与实验感染猪在感染后99天混栏没有转阳,实验感染存活的猪组织中也没有分离到病毒,表明存活下来的感染猪并不会长期带毒,而是随着时间的推移,病毒载量逐渐降低,并最后完全清除病毒。这一结果也与之前的几项研究结果一致。近日,中国农业科学院哈尔滨兽医研究所猪烈性传染病创新团队在非洲猪瘟病毒(ASFV)调控宿主炎性反应研究领域取得新进展,首次发现,ASFV编码的蛋白H240R(pH240R)通过降解核因子κ增强子结合蛋白(NF-κB)调控关键因子(NEMO)的表达和抑制NOD样受体热蛋白结构域相关蛋白3(NLRP3)的寡聚化进而拮抗促炎性细胞因子白细胞介素1β(IL-1β)的产生,相关研究结果以“The H240R Protein of African Swine Fever Virus Inhibits Interleukin 1β Production by Inhibiting NEMO Expression and NLRP3 Oligomerization”为题发表在《Journal of Virology》杂志上。ASFV是引起非洲猪瘟(ASF)的病原,ASF是目前威胁全球养猪业的一种烈性传染病。在前期研究中,该团队首次将pH240R鉴定为ASFV的一个衣壳蛋白,其影响病毒粒子的组装,缺失 H240R 基因的ASFV(ASFV-ΔH240R)感染猪原代肺泡巨噬细胞(PAM)诱导了大量促炎性细胞因子IL-1β的产生(Zhou et al., J Virol. 2022 96:e0166721),然而,pH240R调控IL-1β产生分子机制尚不明确。该研究在前期研究基础上深入解析了pH240R拮抗IL-1β产生的分子机制。研究显示,ASFV-ΔH240R感染PAM明显激活了促炎性反应相关的NF-κB和NLRP3炎性小体信号通路。进一步研究发现,pH240R经过自噬-溶酶体途径降解NEMO进而抑制NF-κB调控的IL-1β 信使RNA(mRNA)的转录(第一信号)。除此之外,pH240R还能够与NLRP3相互作用并抑制其寡聚化,进而降低了成熟IL-1β的释放(第二信号)。同时,应用特异性抑制剂和小干扰RNA(siRNA)分子处理PAM细胞,阻断NF-κB和NLRP3炎性小体信号通路的活化,显著地抑制了ASFV-ΔH240R的复制。结果表明,pH240R通过拮抗IL-1β产生的第一信号和第二信号通路,进而抑制了IL-1β的产生。该研究是猪烈性传染病创新团队继发现pH240R是ASFV的一个新的衣壳蛋白之后,再次对该蛋白的功能进行的深入阐释。相关研究为系统揭示ASFV的形态发生机制以及调控宿主天然免疫反应的分子机理提供了科学依据,并为研发新型抗病毒策略提供候选靶标。该研究受国家自然科学基金联合基金项目(U20A2060)、面上项目(32072866、32072855和32072854)和中国农业科学院科技创新工程等项目资助。博士研究生周萍萍、硕士研究生戴静雯和张柯慧为文章的共同第一作者,李素副研究员、仇华吉研究员和孙元研究员为文章的共同通讯作者